こんにちは(@t_kun_kamakiri)(‘◇’)ゞ
本記事では「エントロピー」についてできるだけわかりやすく解説をしたいと思います。
実際にエントロピーは熱力学の中でも理解しがたい概念であるのに、物理を学んだことがない人でも以外に知っている用語でもあります。
当ブログでは以下のような構成で記事を書いていきます。
- はじめてでもわかるエントロピーの意味
- エントロピーの意味をわかりやすく解説。不可逆性と取りうる状態の場合の数。
- エントロピーは熱/温度と定義する
- エントロピー増大の法則をわかりやすく解説
- 断熱自由膨張は断熱過程でもエントロピー増大する
エントロピーを熱力学の観点からなぜ「エントロピーを乱雑さの度合い」と表現されるのかをわかりやすく解説する。
エントロピーについて以下の認識を持っている方も多いのではないでしょうか?
しかし、エントロピーには様々な意味合いがあります。
エントロピーを理解するためには、マクロな視点とミクロな視点の両方が必要になります。
エントロピーとは何か
前置きでエントロピーについて語りましたが再度エントロピーとは何かを述べることにします。
- 不可逆性を示す指標
- 分子の取りうる状態の場合の数の指標
本記事では熱力学でのエントロピーの定義と、統計力学でのエントロピーの定義の2つにわけて解説を行います。
熱力学でのエントロピーの定義
熱力学でのエントロピーは「不可逆性の指標」になります。
不可逆性の話は今まで一切になかったのに急に出てきてびっくりする人も多いでしょう。
これは熱力学でのエントロピーの定義から言えることです。
不可逆性についてわからない方もいると思います。エントロピーを理解するうえで不可逆性はとても重要な用語ですので是非覚えておいてください。
可逆性と不可逆性
「エントロピーは不可逆性を示す指標」と言いましたが、もっとわかりやすく言うと「方向性のある現象の度合い」と言い換えることができます。
不可逆性とは、自然に起こりうる状態が決まっており、ある状態から別の状態への変化は起こすけどその逆は起こりえない性質のことを指します。
具体例を出して解説をしましょう。
可逆性
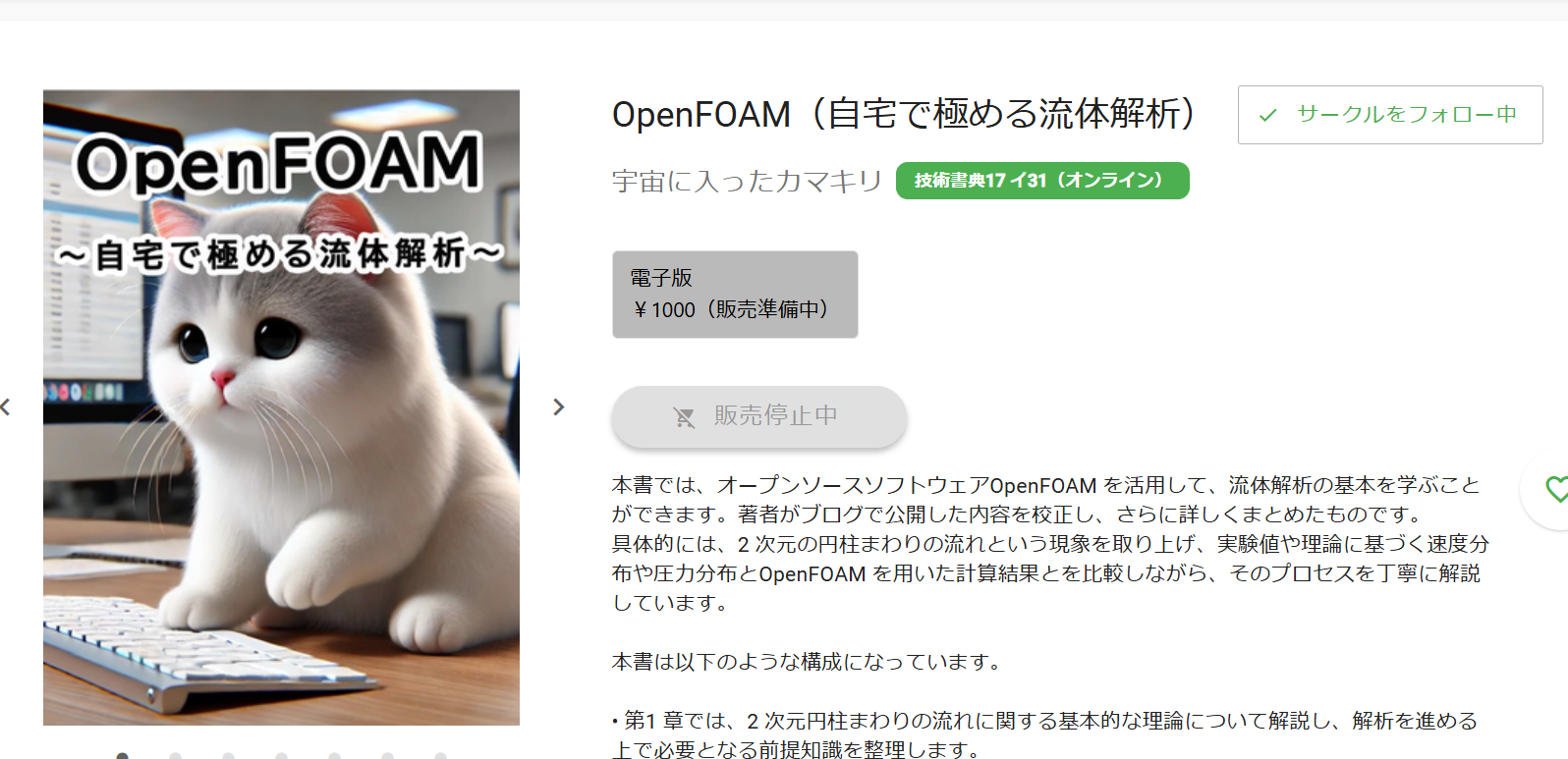
■ボールをはねるとボールはバウンドしてもとの高さまで戻ります。
これは位置エネルギーが地面に到達する頃には全てが運動エネルギーに変わり、壁からの反力で逆向きの運動エネルギーに変わり、また元の高さまで戻るという現象です。

これをビデオで撮影して逆再生しても何も不思議ではありませんよね。
なぜなら運動方程式から$m\frac{d^2 x}{dt^2}=F$の$t$を$-t$にしただけですからね。
元の状態に戻ることができる性質が可逆性です。
では、不可逆性の例を見てみましょう。
不可逆性
不可逆性とは元の状態に自然に戻ることはない性質のことを言います。
■花瓶を床に落として花瓶がバラバラになる。これが待っていると自然と割れていない花瓶の状態も戻る?


■コーヒーにミルクを垂らす。はじめは白い液が固まっていたがだんだんと広がっていく。しかし、待っていると自然とまた白い液が一か所に固まり始める?


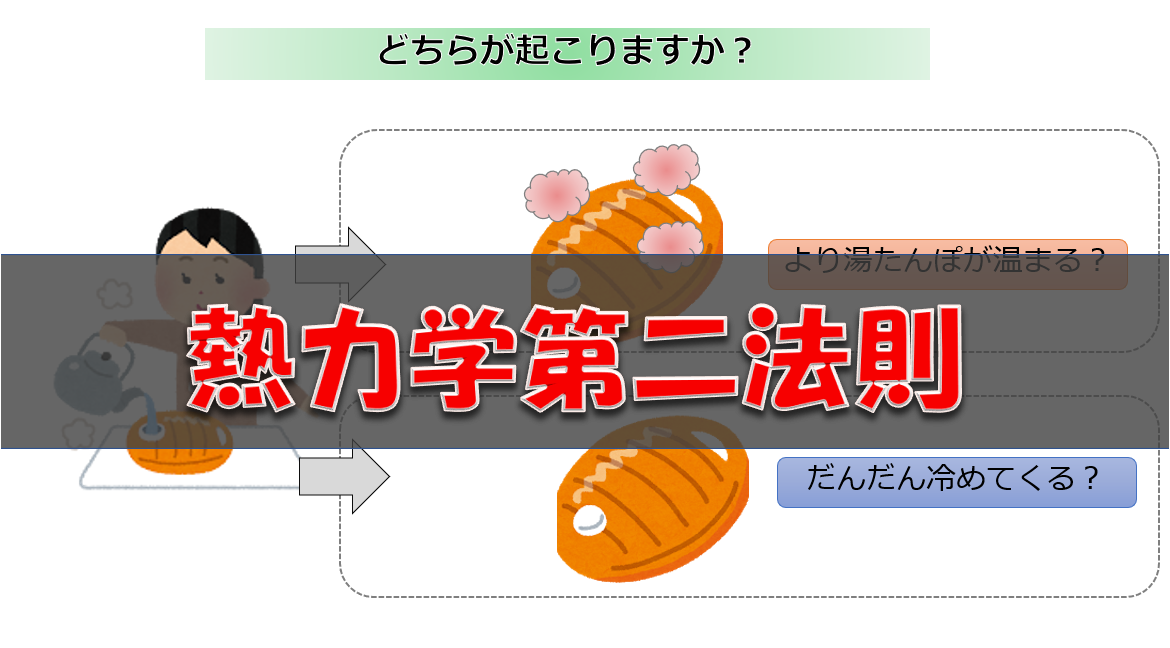
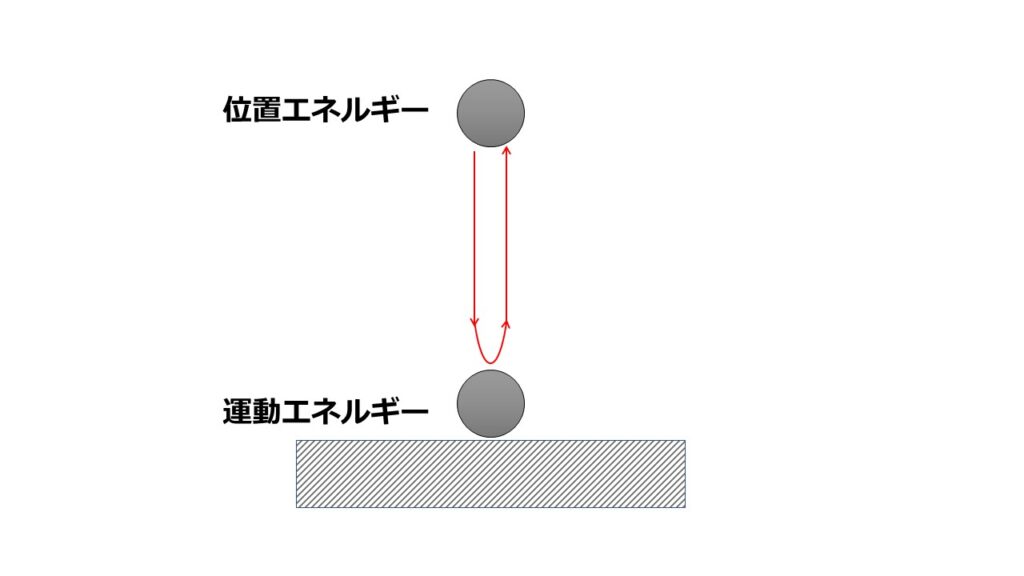
■室温20℃の部屋で温めていた80℃のお湯を入れた湯たんぽを放置していると冷めてしまった。しかし、待っていると再び湯たんぽが温まり始める?

この現象を見て「そんなことありえない」と思っていただければ、不可逆性についての理解をできていると思います。
これは熱力学第二法則に関係していることです。
上で挙げた例は何も手を加えずに実現することは無理ですよね。
自然に戻ることがない
これが不可逆性です。
確かに意図的に手を加えれば、割れた花瓶が元に戻すことができるしミルクも一か所に固めることができます。湯たんぽを温めれば確かに元に戻ります。
ここでいう不可逆というのには「自発的に起こる変化の方向」があって、手を加えなければ起こりえない方向の事を言っています。
自発的に変化する向きであるエントロピーを定量化
系の状態は自発的に変化する向きを定量的に評価できないか?ということを考えます。
この難しい概念を定量的に評価してくれるのがエントロピーの役割といえるでしょう。
エントロピーを以下のように定義します。
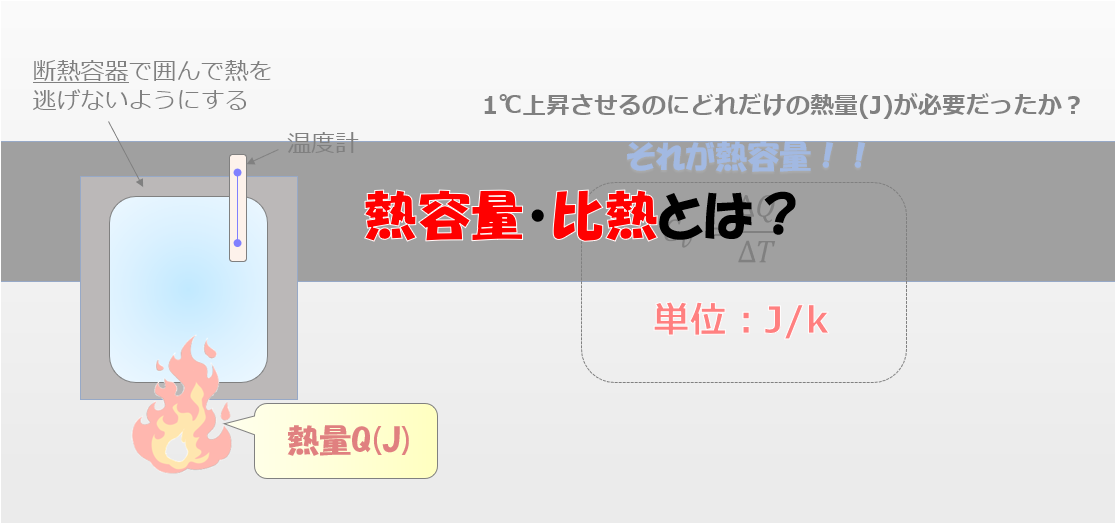
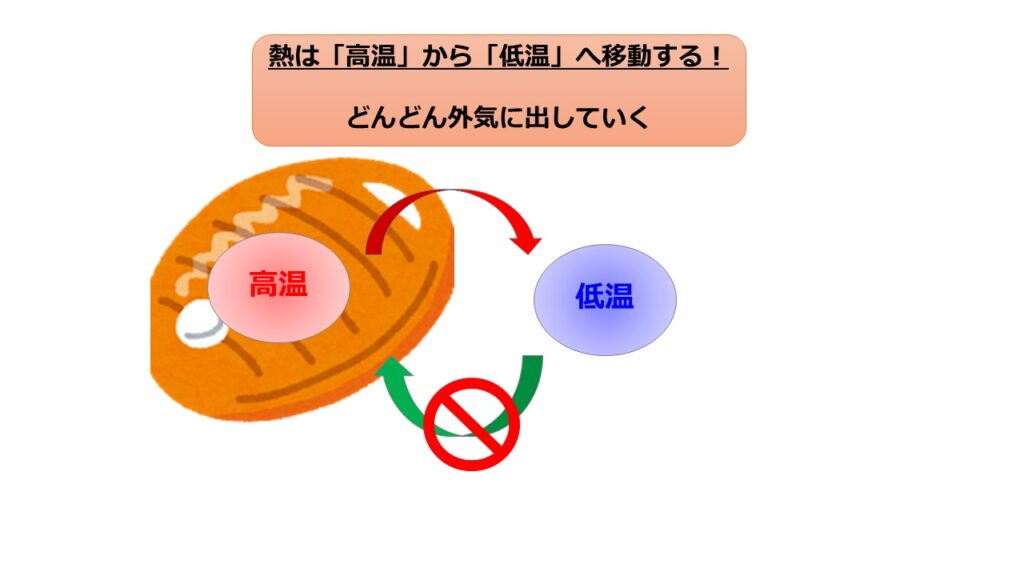
$$\Delta S = \frac{Q}{T}$$
言葉で書くと、エントロピー変化を$\Delta S$は出入りした熱量$\Delta Q$を温度$T$で割ったものと定義されます。
微分形式で書くのであれば$dS=\frac{d^{\prime}Q}{T}$と書けます。
エントロピーは$dS$と書いているのに熱量に関して$dQ$と書かずに$d^{\prime}Q$と書いているのには理由があります。
エントロピーは状態量なので$\Delta S=S_{終}-S_{始}$と始めの状態と終わりの状態の差で書くことができますが、熱量は状態量ではないので出入りした熱量はどのように熱が入ってきたかという積分値$Q=\int dQ$でしか書けないため$\Delta Q=Q_{終}-Q_{始}$のような書き方ができません。
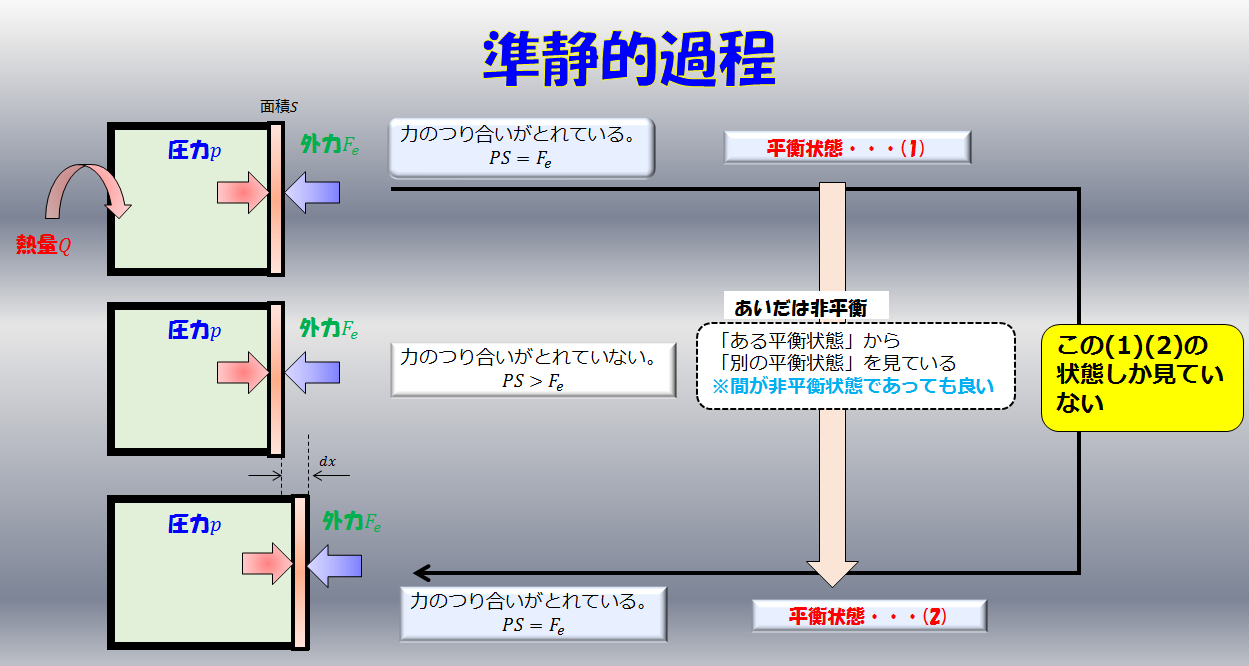
また、注意して欲しいのはエントロピーが$dS=\frac{d^{\prime}Q}{T}$とイコールで結んで定義できるのは熱の出入りが準静的過程の場合だけです。
準静的過程とはゆ〜っくり、ゆ〜っくり熱の出入りがある過程のことで、その過程では熱平衡状態が保たれているため熱力学的な物量が定義できます。
もしここで、熱の出入りが準静的過程ではなく非平衡な過程が含まれる場合には熱力学的な変数が定義できないため当然エントロピーも定義できません。
しかし、過程に非平衡な状態があるからといって熱力学が使えないのかと言うとそういうわけではなく、熱力学はある熱平衡な状態から別の熱平衡状態への変化を扱う学問であるため、間に平衡状態があっても構わないのです。ただ、非平衡状態がある場合のエントロピーは$dS=\frac{d^{\prime}Q}{T}$ではなく、$dS>\frac{d^{\prime}Q}{T}$となります。
つまり、準静的過程で定義できる熱力学の変数$\frac{d^{\prime}Q}{T}$(左辺)よりもエントロピーは増えていますよということです。
言い換えると自然に変化する過程において非平衡な状態があればエントロピーは増えるということです。
そして、非平衡な過程があると自然には元に戻らない不可逆性となります。
- エントロピーは$dS=\frac{d^{\prime}Q}{T}$と定義する。
- 自然に変する過程で非平衡な状態があればエントロピーは増える。
- 孤立系において状態量であるエントロピーを計算するとして、エントロピーの大きい状態に自発的に変化する。
エントロピーの定義を上記のようにすることを認めましょう。
エントロピーの気持ち
エントロピーが$\Delta S = \frac{Q}{T}$を認めろと言われてもなかなか受け入れがたいと思います。
そこでここではエントロピーの気持ちの部分だけを解説をしてイメージをつかんでいただければと思います。
エントロピーは不可逆性の指標になる量であると言いましたが、過程の結果がバラバラで乱雑なように見えるのもまた事実です。
※ここでの乱雑とは「取りうる状態の場合の数」と置き換えてください。
乱雑と表現した方が日常的でわかりやすいためあえてそのような用語を使っています。
そのバラバラで乱雑な要因は熱が生み出しています。エントロピーの分母ですね。
そして元のバラバラさ加減である温度で割って、乱雑さの増え方を表現した式がエントロピーです。

同じ熱量を加えても温度が大きい場合には元の乱雑さが目立つのでさらなる乱雑さは目立たない・・・・つまり、エントロピーはさほど増えないのに対して、温度が小さい場合は元が整理されている状態なのでバラバラにする要因である熱が加えられると乱雑さが際立ちます・・・つまり、エントロピーが急に増えます。


エントロピーは単位温度(バラバラ加減)による、熱量(バラバラの要因)の影響度ともいえます。
統計力学でのエントロピーの定義
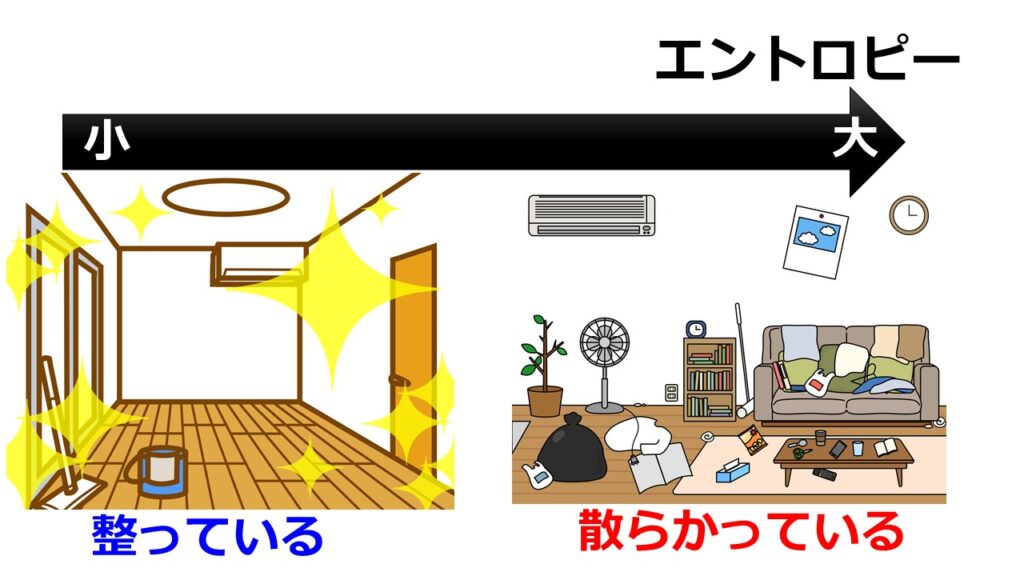
統計力学でのエントロピーは「取りうる状態の場合の数」を意味します。
部屋に例えると「モノの置き場を決めていると取りうる場合の数が少なくエントロピーが小さい」「モノの置き場を決めていないと取りうる場合の数が大きくエントロピーが大きい」と言えます。
エントロピーとは「取りうる状態の数」に関係している。
「部屋にモノをどこでもおいてもいいですよ」と言われれば取りうる状態の数は大きく部屋が散らかりエントロピーは大きい。
「部屋でのモノの配置はこれ」と決めておけば取りうる状態の数は小さく整理されエントロピーは小さい。#エントロピー— カマキリ🐲Python頑張る昆虫 (@t_kun_kamakiri) January 9, 2022
「エントロピー=乱雑さの度合い」と解釈されるのは、統計力学でのエントロピーの定義からですね。
エントロピーは取りうる状態の場合の数と関係
エントロピーは不可逆性の指標になるという話をしましたが、エントロピーは取りうる状態の数とも関係しています。
熱力学では自然に起こりうる変化の方向として定量化したものがエントロピーなのでしが、その後ボルツマンが分子の取りうる状態の数に着目してエントロピーを定義しました。
これは統計力学でのエントロピーの定義です。
$$S=k_B\log_{e}W$$
$W$:取りうる状態の場合の数
断熱自由膨張を例にとってエントロピーを考えましょう。状態Aから仕切りをとった状態で分子は自由に動き回ることを許されます。
理想気体という仮定の下であれば分子同士の相互作用は働かないとしているため、各分子は左右のどちらかに存在することを許されます。
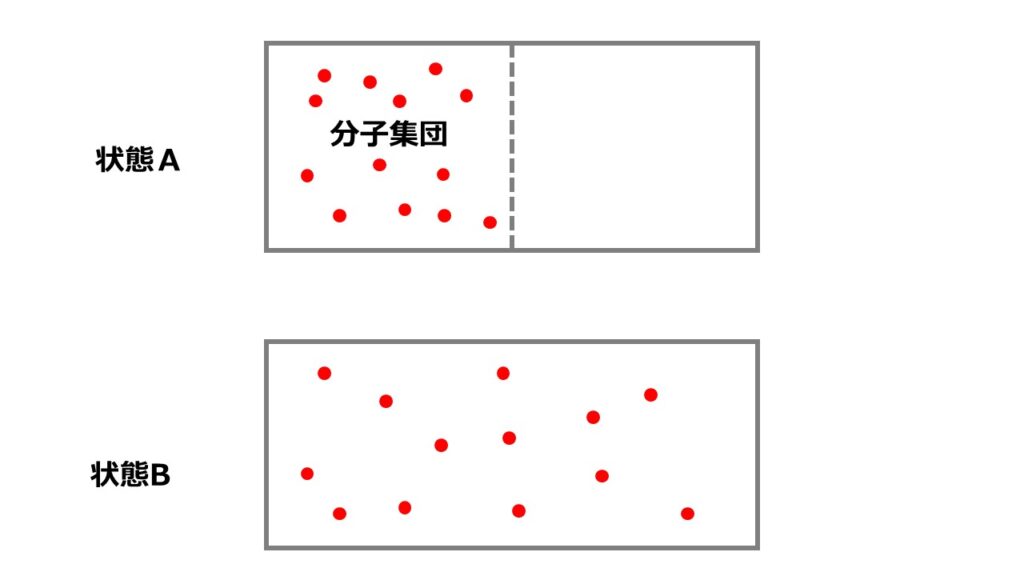

状態Aか状態Bでどちらが実現確率が高いかを計算してみましょう。
全ての分子が左側の部屋に集結する確率
仕切りを取り除いて状態Aのように全ての分子が左の部屋にいる確率を計算してみましょう。
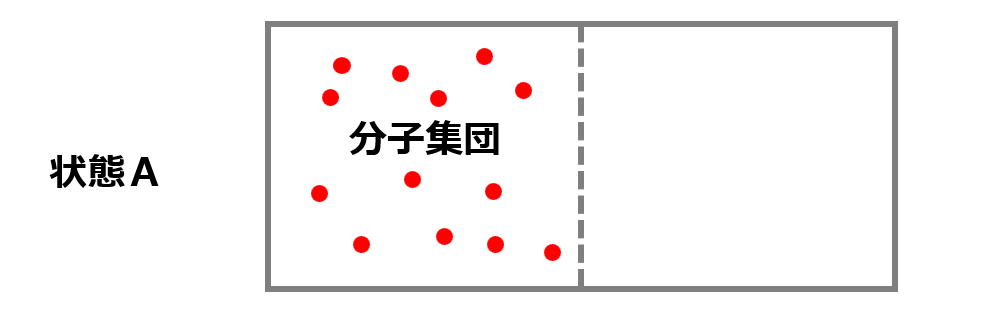

左の部屋にしか分子がいないためひとつの分子で確率は$\frac{1}{2}$です。
粒子が10個存在するとすると
p &=\frac{1}{2}\times\frac{1}{2}\times\cdots \frac{1}{2}\\
&= \frac{1}{2^{10}}\\
&=\frac{1}{1024}
\end{align*}
とものすごい小さな確率になりました。
つまり、全ての分子が片方の部屋に存在する状態Aのような状態は確率的にも低くて起こりえないということになります。
取りうる状態場合の数は、各分子どちらかの部屋なので$w=1$通りしか与えられていません。分子が10個あれば場合の数は
$$W=w_{1}\times w_{2}\times \cdots \times w_{10} = 1$$
取りうる状態は1通りしかないですね。
どちらかの部屋に分子が存在する確率
状態Bの確率を計算してみましょう。
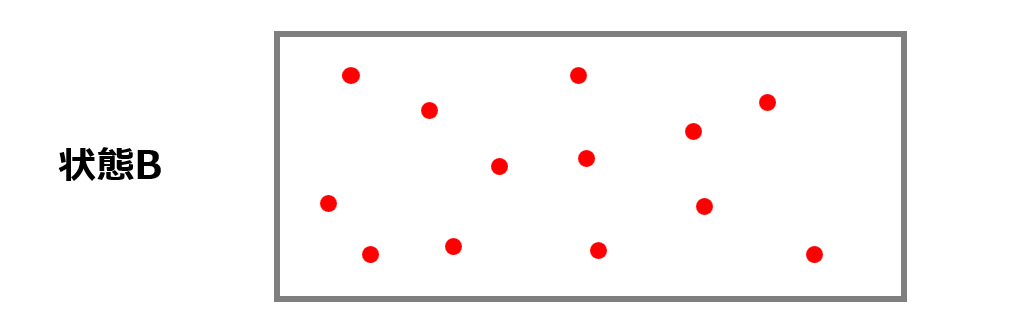

分子は「右か左にいる」ので各分子で確率は$1$になります。
よって、分子が10個存在する場合にどちらかの左右のどちらかの部屋に分子が存在する確率は
$$p=1^{10}=1$$
です。
これは当然ですよね。
分子が右か左にいる確率・・・・つまり、とにかく容器にいる確率を聞かれているのとおなじですから。
つまり、状態Bの方が状態Aよりも圧倒的に実現する確率が高いことになります。
取りうる状態場合の数は、各分子どちらかの部屋を選択しても良いので$w=2$通り与えられます。分子が10個あれば場合の数は
$$W=w_{1}\times w_{2}\times \cdots \times w_{10} = 2^{10}$$
取りうる状態は1024通りもあります。
冒頭で述べた部屋の例えがわかりやすいでしょう。
というわけで断熱自由膨張での状態を取りうる状態の場合の数で考えると以下のようにまとまります。
このように取りうる状態の場合の数という情報量が多いほど、自然に起こりうる変化の過程が起こりやすくなります。
それを統計力学でのエントロピーを定義すると$S=\log_{e}W$ということです。
まとめ
エントロピーは熱力学第二法則と関係している物理量で、自然に起こりうる変化の過程の指標になる量であることを解説しました。
冷めたお湯が自然に温かくなることがないという感覚的なことを定量化したものがエントロピーです。
まとめると以下となります。
- 不可逆性を示す指標
マクロな視点:熱力学でのエントロピーの定義:$dS=\frac{d^{\prime}Q}{T}$ - 分子の取りうる状態の場合の数の指標
ミクロな視点:統計力学でのエントロピーの定義:$S= k_B\log_{e}W$
熱力学のミクロ的な視点を理解するためには分子の運動を取り入れた統計力学必要であり、統計力学の理解には熱力学が必要であります。
エントロピーの定義式が互いに異なることに違和感があるかもしれませんが、$S=\log_{e}W$から$dS=\frac{d^{Q}}{T}$を導くことができます。