本記事では、熱容量と比熱についてお話したいと思います。
熱容量や比熱は「高校化学」「高校物理の熱力学」で出てきて、当時の僕にとってはとてもイメージの付きづらい用語でした。
そこで本記事では、大学物理を学んでわかるようになってきた熱容量と比熱について以下のことをわかりやすく解説したいと思います。
- 熱容量と比熱の違いを理解しよう
- 熱容量と比熱の意味を理解しよう
- 熱容量と比熱の単位をきちんと覚えよう
両者の違い、意味、単位をきちんと理解して覚えよう(^^)/
高校生でも読める内容にし、最後の章はちょびっとだけ発展した内容となっています(ほんのちょびっとだけ・・・)。
熱容量と比熱の違い
まず結論から先に述べておきましょう。
比熱は、熱容量とは違って「単位質量あたり」という言葉がつきました。
それから比熱は物性であるけど、熱容量は物性値ではないという違いもあります。
ここが熱容量と比熱の違いです。
では、「熱容量」と「比熱」の違いについて以下で詳しく解説していきます。
熱容量とは
まず熱容量とは何かというお話からしていきます。
よくわからないってか(笑)
では、別の言い方をしましょう。
1K(あるいは1℃)上昇させるのに必要な仕事量(J)
もしくは・・
1K(あるいは1℃)上昇させるのに必要なエネルギー量(J)
のことです。
熱容量は言葉だけで言われてもわからないですよね。
そんな時は、こんな絵を想像してみてはいかがでしょうか。
熱容量とはつまりは、加えた熱をどれだけ蓄えることができましたかという量になります。
「熱量って意味わかんないよ」って人は電熱線でもぶち込んでおこう
熱量(J)って言われてもよくわからないって人もいるでしょうね。
ましてや熱量はエネルギーだから、エネルギーを系に注入しているんだって言われたら、は?ってなるでしょうね。
そんなときは、熱量じゃなくて電熱線をぶち込んで電気による発熱で系が温まる様子とかをイメージしましょう(^^)/

電気も仕事をして熱を発しているとかイメージすればよろしい!(^^)!
また、熱容量はこんな言い方もできます。
「温まりにくさ!!」・・・
は?ってか(笑)
こんなイメージです。
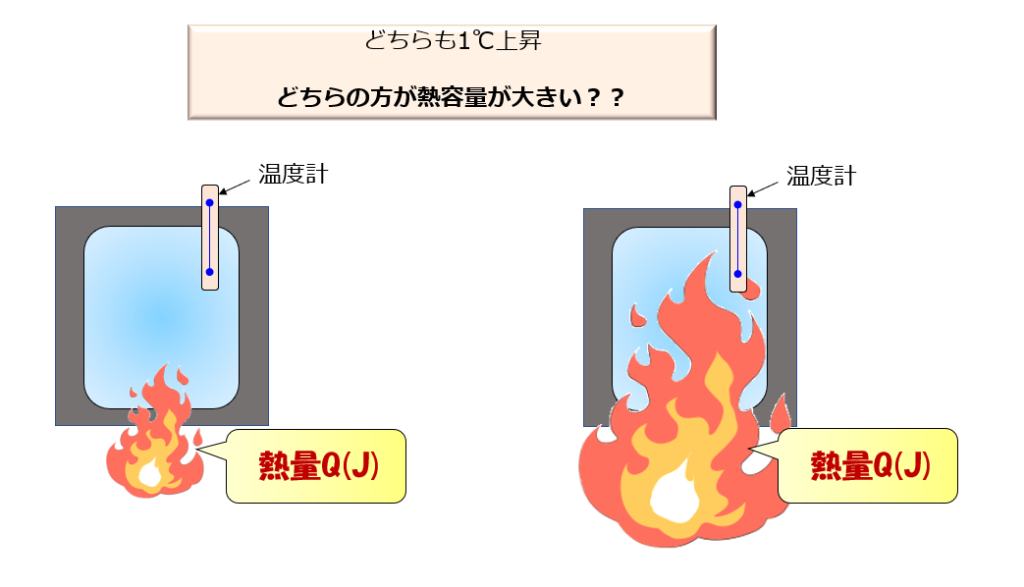
同じ質量の2つの異なる物質を1℃上昇させることを考えましょう。
この時、右の物質のものを1℃上昇させるのにめちゃくちゃ熱量を使って、ようやく1℃上昇したとします。
両者はどちらも1℃の上昇です。
だとすると、右の物質は熱をいっぱい送り込んでようやく1℃上昇するのですから相当な熱量を蓄えることができそうですよね。
ということで熱容量は右の材質の方が大きいということになります。
1℃上昇させるのに、手間を取らせるな!!
ってことで「温まりにくさ!!」(熱容量)です。
質量が大きいだけで熱容量の値は大きくなる
質量が大きくなるだけで熱容量は大きくなります。
下記の絵をイメージしてもらえれば良いです。
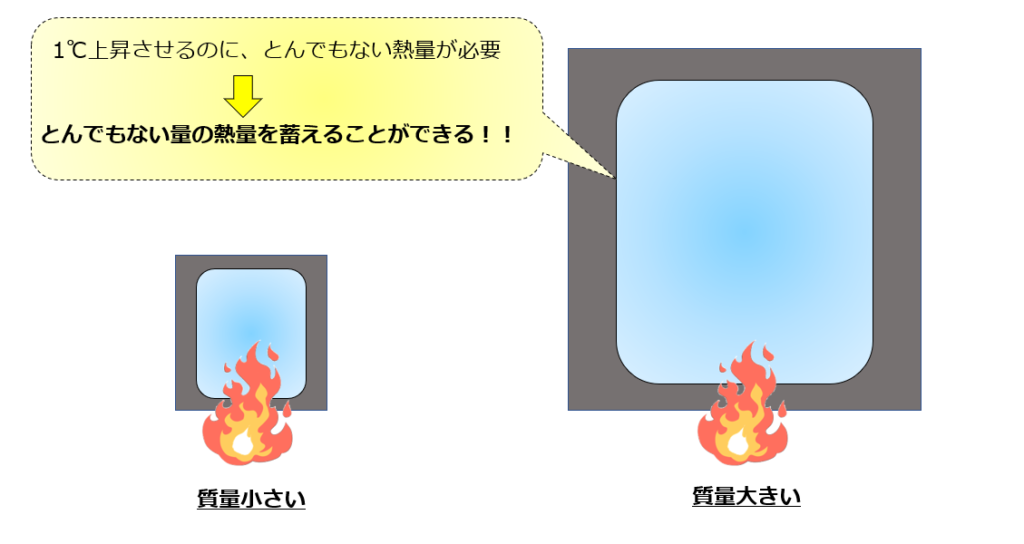
クッソでかい鉄の塊を1℃上昇させることを考えたら、どえらい熱量が必要そうですよね。
そうです。質量が大きいモノの方が熱容量が大きいのです。
先ほどの「温まりにくさ(熱容量)」からも納得することでしょう。
こんな感じで質量によって熱容量、すなわち1℃上昇させるのに必要な熱量(J)というのが異なります。
これを考えると、熱容量はモノ固有の値になっていますよね。
例えば・・・
- 質量が大きいものは、大きな値をとる。
- 温まりにくい材質なら、大きな値をとる。
では、比熱ってなんでしょうかね。
比熱は熱容量を質量で割ったもの
熱容量は、質量が異なるだけで値は異なるという説明をしましたよね。
だったら、単位質量あたりに換算した場合は、物質固有の値(物性値)になるんじゃないかという考え方になります。
これが比熱です。
熱容量とは違って「単位質量あたり」という言葉がつきました。
ここが熱容量と比熱の違いです。
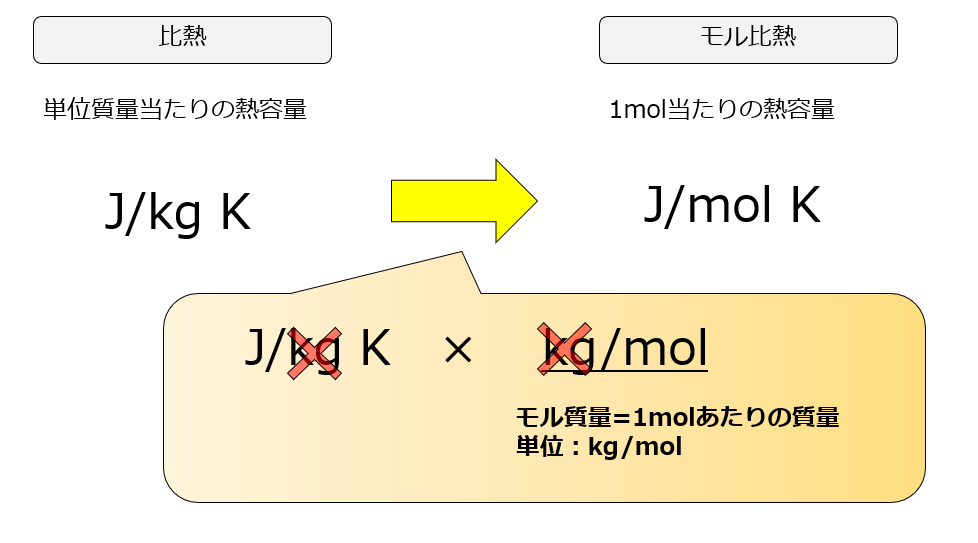
モル比熱も覚えておこう
単に比熱だけを言うと「単位質量あたりの熱容量」か「1molあたりの熱容量」かが区別できませんが、「1mol当たりの熱容量」を特にモル比熱と言ったりします。
1kg(単位質量)あたりで見るか、1molあたりで見るかの違いですので意味合いは対して差はありませんが・・・・
単位には要注意です!!
比熱がいったいどちらのことを指しているのかによって値が違ってくるので、単位は注意深く確認しましょう。
ちなみに、両者の変換の仕方は簡単です。
「単位質量当たりの熱容量(比熱)」にモル質量[kg/mol]を書ければ「モル比熱」になります。
各物質の比熱:例
比熱は物性値として物性表などにこんな感じで記載されています。
| 物質 | 比熱 [J/(g⋅K)] |
|---|---|
| 水 | 4.2 |
| 氷 | 2.1 |
| なたね油 | 2.0 |
| アルミニウム | 0.88 |
| 鉄 | 0.44 |
| 銅 | 0.38 |
| 鉛 | 0.13 |
| 石 | 約0.84 |
| 木材 | 約1.3 |
これを見て水の比熱でかいな!!って思った方はいるかもしれませんね。
水って酸素や窒素と二酸化炭素とかに比べると、沸点がめちゃくちゃ高いですよね。
水の沸点は100℃ですよ。(窒素とか何℃ですか?)
そのあたりの物性値とも関連してくる話ではあると思いますが、詳細は割愛させてもらいますm(_ _)m
まとめ
熱容量と比熱の違い、意味、単位などを説明しました。
以下、詳しくは書かないですが役に立つ知識を紹介しておきます。
実はここで話した比熱は容量変化がない話なので定積比熱です
補足説明になりますが、実は一言に比熱と言っても定積比熱と定圧比熱という名のついたものがあります。
詳しい解説は↓下記の記事をご参考ください。
いきなり数式だらけになりますがチャレンジしてみてください。
比熱は厳密には温度依存性がある
厳密な話をすると比熱は温度依存性があります。
物質の温度が上昇すると比熱というのは多くの場合、上昇していくことが知られています。
要するに、物質の温度が上昇していくと1K(1℃)温度上昇させるのに必要な熱量(J)が大きくなるということです。
へ~って感じですよね☺
確かに、物質が温度上昇しているのにいつまでも同じ状態を保っているとは思えませんよね。例えば分子同士が振動したり分子の運動の自由度が増してきそうです。
では、どうやってそのような温度依存する比熱を数式で表現するかというと、温度の多項式で比熱を表現します。
「あれ?温度依存するぞ!」ってことで補正するのです。
熱力学のおススメの参考書
大学で習う熱力学は、この2冊がめちゃくちゃおすすめです!
熱力学という学問の見方が変わります!
その他にも、おススメの熱力学の参考書を紹介しているので良ければどうぞ(^^)/
熱力学は奥が深いですよね♪

















熱湯量?
ご指摘ありがとうございます。
修正いたしました。