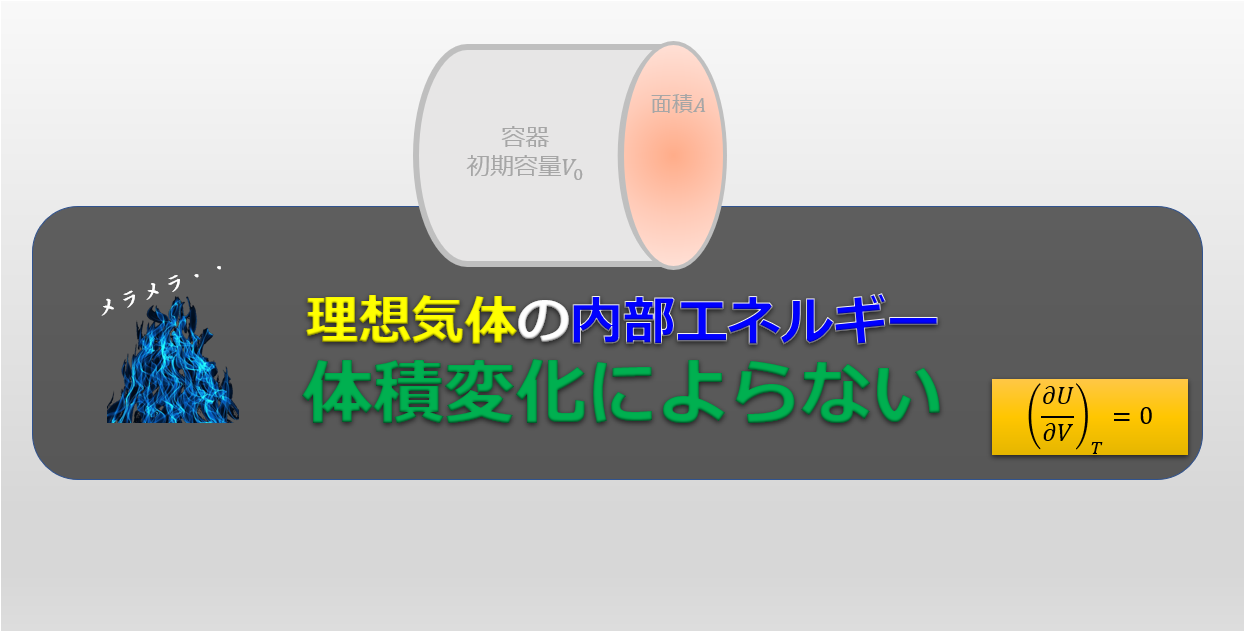
理想気体の状態方程式\(pV=nRT\)を使って、気体の問題について考えた経験はありますか?
※過去にも状態方程式という記事を書きましたが、熱力学の分野でももう一度おさらいする形になります。
理想気体の状態方程式
理想気体の場合は、温度・圧力・体積の関係式は下記のように書けます。
(1)式はもともとは、
ボイルの法則
と、
シャルルの法則
とを気体定数\(R\)というのを導入して、ひとつの式まとめたものです。
個人的に「状態方程式」と言わずに、あえて「理想気体の」と付けて、しっかり前提条件を暗に含めて語るように心がけていますね。
それは、「理想気体の状態方程式」は次のような仮定のもと成立している式であると理解されているからである。
理想気体の状態方程式が成り立つ仮定
理想気体が成り立つ条件は以下の2つです。
(1)分子間力を考慮しない
これは、その名の通り分子間力を考慮していないので、たとえ分子同士が接近してもやはり「分子間力を考慮しない」と言う意味であり、”希薄な状態”であるを指しています。
”希薄な状態”とは多くは気体などのことである。
つまり、水などは分子同士があまりにも接近しているため、分子間力を考慮しなくてはならず、その時点で「理想」とはかけ離れているので、「理想気体の状態方程式」を適用することはできない。
もうひとつ、分子間力が無視できる場合は、「温度が高い状態」の時です。
希薄と言っても、当然粒子同士はある確率で接近するわけで、その場合でも分子間力を考慮しないという意味だけではなく、粒子同士が接近しても運動エネルギーが大きいため、分子間力を感じることなく引力を振り切ってしまいます。
そのような状態であれば、分子間力は無視されます。
(2)粒子の大きさが体積に比べて十分小さい
\(PV=nRT\)の\(V\)は粒子の大きさを考慮されているでしょうか?
答えは、考慮されておらず、単に閉じた空間の体積のみを指しています。
そういう意味で、粒子数が大きくなると(希薄でなくなると)、全粒子の体積(\(b\)とする)は、閉じた空間の体積\(V\)に対して無視できなくなります。
しかし、理想気体を考えている以上は、粒子の大きさは無視できるほど希薄であると考えている。
理想気体の状態方程式\(pV=nRT\)は、上記2つの仮定の上で成り立っていることをよーーく覚えておきましょう!!
このような「理想気体」というものは、そもそも存在しない。
え?
高校生の授業で習った「理想気体の状態方程式\(pV=nRT\)は一体なんだったのか?」
存在しないからと言って愕然とすることはなく、多くの気体における現象は「理想気体」として扱っても実現象を再現しうるのです。
物理現象を理解する上で(3)式のようにシンプルな関係式を使って現象を理解すれば、それで十分なのです。
何も複雑に考えて、物理現象を理解しようとしても無駄な場合も多いです。
少ない情報で、多くのことを理解できれば、むしろその方が賢いやり方であることを肝に銘じつつ、(1)式が成り立つのは(1)(2)の2つの仮定が十分成立すると考えられるときであるというのを認識しておけば良いのです。
そして、(1)(2)が成り立たない場合は、(1)式を補正するれば良いだけだと、軽い気持ちで考えておけば良いでしょう。
理想気体と実在気体を比較すると?
では、理想気体と実在気体を表にして比較してみます。
| 理想気体 | 実在気体 | |
| 分子間力 | 考慮しない(希薄、高温) | 考慮する |
| 分子の体積 | 考慮しない(希薄) | 考慮する |
| 状態方程式 | \(pV=nRT\) |
※\(pV=nRT\)は成り立たない 下記の記事をお読みください |
実在気体である場合は以下の2つを考慮するということですね。
- (1)分子間力を考慮する場合
- (2)分子の大きさを考慮する場合
2つの仮定が成り立たない実在気体の場合はどう考えればよいのでしょうか?
気になる方は下記の記事をお読みください(^^)/